鈉離子內流和過載在人體組織損傷中經常被觀察到,而鈉過載是否會導致壞死性細胞死亡以及其中涉及的機制尚不清楚。
2025 年 2 月 6 日,上海交通大學醫學院鐘清團隊與中國科學院上海藥物所李揚團隊合作,在 Nature 子刊 Nature Chemical Biology 上發表了題為:Persistent activation of TRPM4 Triggers necrotic cell death characterized by sodium overload 的研究論文。
該研究發現并定義了一種以鈉過載為特征的壞死性細胞死亡新形式,并將其命名為——鈉過載細胞壞死(Necrosis by Sodium Overload,NECSO)。

2023 年 4 月,鐘清團隊等發表論文,報道了一種小分子化合物——Necrocide1(NC1),其作為細胞壞死誘導劑,介導人類癌細胞的壞死性細胞死亡和免疫原性反應。更重要的是,其誘導的壞死性細胞死亡與壞死性凋亡、鐵死亡、焦亡以及其他已知的細胞死亡通路不同。

在這項發表于 Nature Chemical Biology 的最新研究中,研究團隊確認了 Necrocide1(NC1)通過鈉離子過載(sodium overload)誘導細胞壞死性死亡,并將這種細胞死亡形式命名為——鈉過載細胞壞死(Necrosis by Sodium Overload,NECSO)。
Necrocide1(NC1)作用于非選擇性單價陽離子通道 TRPM4,從而促進鈉離子內流和細胞壞死。TRPM4 缺陷細胞對 NC1 誘導的 NECSO 具有抗性。由于跨膜區存在差異,NC1 特異性激活人類的 TRPM4 而非小鼠的 TRPM4,這一點通過結構域交換和分子對接得以揭示。
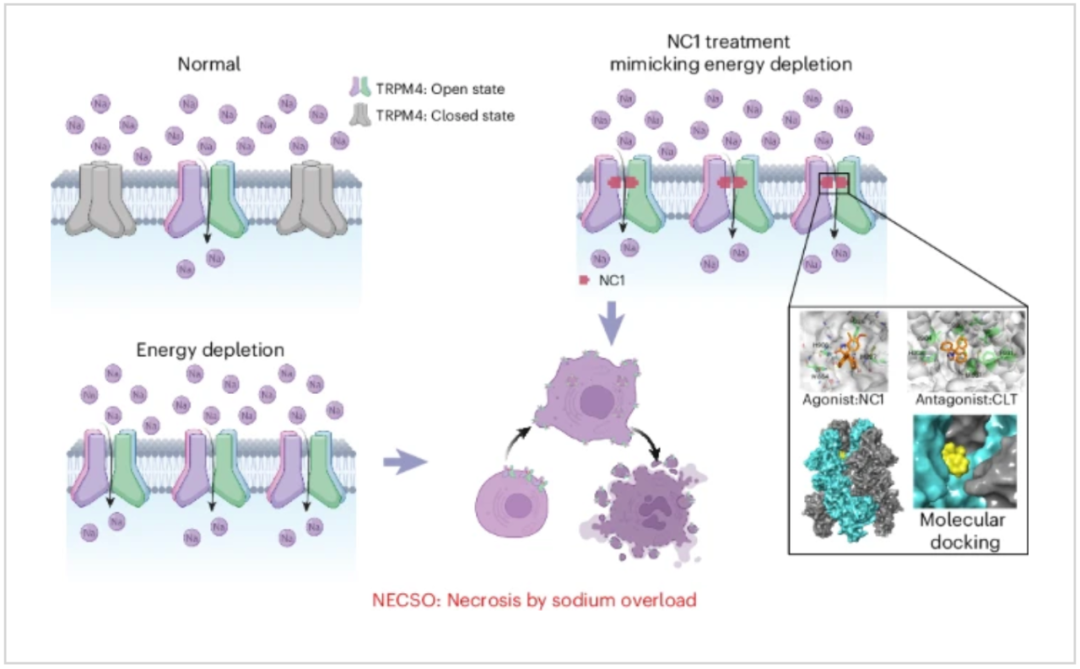
TRPM4 基因突變與心律失常有關,該研究發現,與心律失常有關的人類 TRPM4 功能增益(GOF)突變對由 NC1 或 2-脫氧-D-葡萄糖(2-DG,一種糖酵解抑制劑)觸發的 NECSO 顯示出更高的易感性,而 TRPM4 基因敲除的人類心肌細胞則對這兩種情況更加耐受。這表明了 TRPM4 介導的 NECSO 可能在能量缺失誘發的心臟疾病中發揮重要作用。
此外,研究團隊還通過化學篩選鑒定出了能抑制由 NC1 或能量耗竭誘導的細胞壞死的 NECSO 抑制劑——二氫吡啶類鈣通道阻滯劑(DHP-CCB)和克霉唑(Clotrimazole)。總的來說,這項研究為受控鈉離子內流介導的細胞壞死及其對疾病的影響提供了新見解。