基因組編輯技術CRISPR/Cas9被《科學》雜志列為2013年年度十大科技進展之一,受到人們的高度重視。CRISPR是規律間隔性成簇短回文重復序列的簡稱,Cas是CRISPR相關蛋白的簡稱。CRISPR/Cas最初是在細菌體內發現的,是細菌用來識別和摧毀抗噬菌體和其他病原體入侵的防御系統。
圖片來自Thomas Splettstoesser (Wikipedia, CC BY-SA 4.0)。
2018年11月26日,中國科學家賀建奎聲稱世界上首批經過基因編輯的嬰兒---一對雙胞胎女性嬰兒---在11月出生。他利用一種強大的基因編輯工具CRISPR-Cas9對這對雙胞胎的一個基因進行修改,使得她們出生后就能夠天然地抵抗HIV感染。這也是世界首例免疫艾滋病基因編輯嬰兒。這條消息瞬間在國內外網站上迅速發酵,引發千層浪。有部分科學家支持賀建奎的研究,但是更多的是質疑,甚至是譴責。
即將過去的3月份,有哪些重大的CRISPR/Cas研究或發現呢?小編梳理了一下這個月生物谷報道的CRISPR/Cas研究方面的新聞,供大家閱讀。
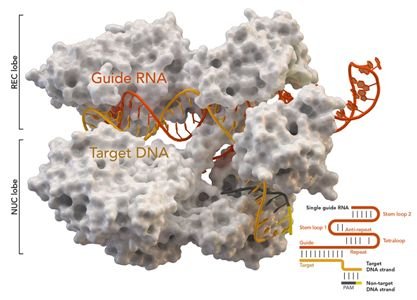
1.Science:重大進展!經過改進的CRISPR-Cas9不受PAM的限制,可靶向整個基因組中的任何位點
doi:10.1126/science.aba8853
許多基礎研究人員和臨床研究人員正在測試利用一種簡單有效的基因編輯方法來研究和校正導致從失明到癌癥等各種疾病的致病突變的潛力,但是這種技術受到一定限制,即必須在基因編輯位點附近存在某個較短的DNA序列。
如今,來自美國麻省總醫院(MGH)的研究人員對這個基因編輯系統進行了改進,使得它幾乎不再受到這種限制,從而有可能潛在地靶向整個人類基因組中的任何位點。相關研究結果于2020年3月26日在線發表在Science期刊上,論文標題為“Unconstrained genome targeting with near-PAMless engineered CRISPR-Cas9 variants”。
CRISPR/Cas9基因組編輯技術是一種免疫防御策略,被細菌用來切割入侵病毒的DNA。為了使得這種CRISPR-Cas9系統發揮作用,一種稱為Cas9的細菌防御蛋白會尋找一個較短的稱為間隔序列鄰近基序(protospacer adjacent motif, PAM)的區域,這個區域存在于病毒DNA中,但不存在于細菌DNA中。CRISPR-Cas9已被用于編輯人類基因組,這是因為這樣的PAM序列在我們的DNA中也很常見;但是,人們不能靶向不位于PAM附近的基因。為了克服這一障礙,在麻省總醫院基因醫學中心生物化學家Benjamin P. Kleinstiver的領導下,這些研究人員通過基因改造設計出兩種不需要特定PAM就可結合和切割DNA的Cas9蛋白變體,并將它們命名為SpG和SpRY。這兩種蛋白變體可允許以常規CRISPR-Cas9酶無法達到的效率編輯DNA序列。
Kleinstiver說,“鑒于這些經過改造的蛋白可以更自由地靶向DNA序列,因此它們可以靶向以前無法進入的基因組區域。通過幾乎完全放松Cas9對識別PAM的要求,如今許多基因組編輯應用是可以實現的。鑒于幾乎整個基因組都是可靶向的,因此最令人興奮的意義之一是從DNA編輯的角度來看,整個基因組都是‘藥物可靶向的(druggable)’。”
2.bioRxiv:華人科學家開發出AIOD-CRISPR技術,可快速超靈敏地可視化檢測SARS-CoV-2和HIV
doi:10.1101/2020.03.19.998724
隨著近期導致2019年冠狀病毒病(COVID-19)的病原體SARS-CoV-2疫情爆發,在一項新的研究中,康涅狄格大學健康中心生物醫學工程系副教授Changchun Liu及其團隊開發出一種稱為“All-In-One-Dual CRISPR-Cas12a(AIOD-CRISPR)”的方法,以實現對SARS-CoV-2和HIV病毒的簡單、快速、超靈敏的目視檢測,旨在在家中或小型診所中使用。相關研究結果于2020年3月21日發表在預印本服務器bioRxiv上,論文標題為“All-in-One Dual CRISPR-Cas12a (AIOD-CRISPR) Assay: A Case for Rapid, Ultrasensitive and Visual Detection of Novel Coronavirus SARS-CoV-2 and HIV virus”。
聚合酶鏈反應(PCR)方法目前被認為是疾病診斷的“金標準”。但是,PCR方法依賴于昂貴的設備和訓練有素的人員。 Liu的方法與PCR不同,是等溫的(?37°C),并且與其他等溫擴增技術不同的是,它具有更好的靈敏度和特異性。
在Liu的實驗室中,他的AIOD-CRISPR系統成功地檢測出SARS-CoV-2和HIV的DNA和RNA。此外,通過檢測從人血漿樣品中提取的HIV-1 RNA,對這種方法進行了評估,它獲得了與PCR方法相當的結果。
3.Nat Biotechnol:中科院高彩霞團隊成功開發植物基因組引導編輯技術
doi:10.1038/s41587-020-0455-x
在此之前,美國哈佛大學的David R. Liu和他的同事們開發出一種新的稱為引導編輯(prime editing)的基因組編輯方法。這種方法使用工程化的Cas9切口酶(H840A)-逆轉錄酶(RT)融合蛋白和引導編輯向導RNA(prime editing guide RNA, pegRNA),可在人細胞中進行所需的編輯。
在一項新的研究中,中國科學院遺傳與發育生物學研究所的高彩霞(Gao Caixia)教授及其研究團隊對一種引導編輯系統(prime editing system, PPE)進行優化,從而在兩種主要的谷類作物中產生所需的點突變、 插入和缺失。PPE系統的主要成分是Cas9切口酶-RT融合蛋白和pegRNA。相關研究 結果近期發表在Nature Biotechnology期刊上,論文標題為“Prime genome editing in rice and wheat”。
通過使用這種PPE系統,這些研究人員在原生質體中在9個水稻位點和7個小麥位點上產生了所有12種類型的單堿基替換,以及多種點突變和小DNA片段插入,效率高達19.2%。這種PPE系統的編輯效率受到引導結合位點(primer binding site, PBS)和RT模板長度的強烈影響。
盡管這種PPE系統會產生副產物(脫靶效應),但是可以通過優化RT模板長度來減少這些副產物。此外,通過使用針對植物優化的PPE系統,他們發現初始的RT可以被CaMV-RT(來自花椰菜花葉病毒)和反轉錄子衍生性RT(來自大腸桿菌BL21)替換。通過使用PPE-Ribozyme(PPE-R)并在37°C下孵育,針對一些靶標的引導編輯效率也可得到改善。
此外,高彩霞教授和她的合作者能夠構建穩定的攜帶G-to-T點突變、多核苷酸替換和許多所需的6nt缺失的突變水稻植株,它們的產生效率接近22%。值得注意的是,使用當前的編輯工具很難產生這三種類型的突變。
4.Science子刊:使用CRISPR尋找肌肉營養不良的治療方法
doi:10.1126/scitranslmed.aay0271
由波士頓兒童醫院的Louis Kunkel博士和研究員Angela Lek博士領導的一項新研究表明,CRISPR-Cas9技術可以幫助研究者們更好地了解肌營養不良癥(FSHD)并探索潛在的治療方法。 FSHD會導致面部、肩胛骨和上臂肌肉無力,目前除支持治療外沒有其他治療方法。
在FSHD中,通常主要在胎兒發育過程中活躍的DUX4基因被不適當地“打開”。這會導致有毒的DUX4蛋白在不應出現的情況下在肌肉細胞中產生,從而導致細胞死亡和肌肉無力。
Kunkel、Lek及其同事想知道是否可以靶向其他基因來預防或彌補這一問題。他們決定使用CRISPR-Cas9系統地讓基因組中的每個基因發生突變。他們的目標是:找到被敲除的基因,即使DUX4蛋白存在的情況下也能使人的肌肉細胞存活。CRISPR-Cas9篩選產生了大約六個比較符合要求的“靶標”,其中有幾個基因在細胞對低氧條件或缺氧的反應中起作用。事實證明,這正是DUX4導致細胞死亡的主要驅動力。當研究小組將肌肉細胞暴露于已知能抑制這種低氧反應的化合物時,這些細胞就可以存活。
更進一步,該團隊從實際患有FSHD的患者中創建了肌肉細胞系。當用相同的化合物治療時,這些細胞顯示出較少的疾病已知生物標志物。最后,研究人員創建了兩個FSHD的活斑馬魚模型。當他們將魚暴露于抑制缺氧信號轉導的化合物時,斑馬魚的肌肉結構和功能得到改善,游泳活動增強。
5.bioRxiv:突破!科學家用CRISPR剪切新冠病毒基因組以治療COVID-19
doi:10.1101/2020.03.13.991307
近日來自斯坦福大學生物工程系等單位的研究人員開發了一種基于CRISPR -cas13的策略,PAC-MAN (Prophylactic Antiviral CRISPR in huMAN cells,人類細胞中的預防性抗病毒CRISPR),用于有效降解人肺上皮細胞中的SARS-CoV-2序列和活的甲型流感病毒(IAV)基因組,從而實現有效的病毒抑制。
研究人員設計并篩選了一組針對保守病毒區域的CRISPR RNA (crRNAs),并鑒定了用于剪切SARS-CoV-2基因組的功能crRNAs。研究人員發現該方法可以有效減少甲型H1N1流感病毒的呼吸道細胞病毒復制。他們還通過生物信息學分析顯示,一個只有6個crRNAs的組合可以靶向90%以上的冠狀病毒。
6.Nat Biotechnol:利用新型CRISPR/Cas13靶向冠狀病毒SARS-CoV-2等RNA病毒
doi:10.1038/s41587-020-0456-9
基于CRISPR的遺傳篩選已幫助科學家們鑒定出在鐮狀細胞性貧血、癌癥免疫療法、肺癌轉移和許多其他疾病中起關鍵作用的基因。但是,這些基因篩選的范圍是有限的:它們只能編輯或靶向DNA。對于人類基因組的許多區域,靶向DNA可能并不有效,而且也無法通過現有的DNA靶向性CRISPR篩選靶向諸如RNA病毒(比如冠狀病毒或流感病毒)之類的其他有機體。
如今,在一項新的研究中,來自美國紐約基因組中心和紐約大學的研究人員開發出一種新的CRISPR篩選技術,用于靶向RNA。相關研究結果近期發表在Nature Biotechnology期刊上,論文標題為“Massively parallel Cas13 screens reveal principles for guide RNA design”。論文通訊作者為Neville Sanjana博士。論文第一作者為博士后研究員Hans-Hermann Wessels和博士生Alejandro Méndez-Mancilla。
這些研究人員利用了一種最近描述過的稱為Cas13的酶,該酶靶向RNA而不是DNA。通過使用Cas13,他們設計了一個優化平臺,用于在人細胞中在RNA水平上大規模并行遺傳篩選。這種篩選技術可用于了解RNA調節的許多方面,并確定非編碼RNA的功能。
通過靶向人RNA轉錄本中成千上萬個不同的位點,這些研究人員開發出一種基于機器學習的預測模型,以加快鑒定最有效的Cas13向導RNA(gRNA)。這種新技術可以讓科學家們通過交互式網站和開源工具箱加以使用,以預測定制RNA靶標的gRNA效率,并為所有人類蛋白編碼基因提供預先設計的gRNA。
7.mBio:利用噬菌體遞送CRISPR-Cas3有望治療艱難梭菌感染
doi:10.1128/mBio.00019-20
在一項新的研究中,來自美國Locus Biosciences公司和北卡羅萊納州立大學等研究機構的研究人員發現CRISPR-Cas系統可用于有效靶向并消除特定的腸道細菌,即一種引起結腸炎的病原體:艱難梭菌(Clostridioides difficile)。相關研究結果近期發表在mBio期刊上,論文標題為“In Vivo Targeting of Clostridioides difficile Using Phage-Delivered CRISPR-Cas3 Antimicrobials”。
在這項概念驗證研究中,這些研究人員測試了利用一種稱為噬菌體的病毒攜帶可編程的CRISPR來特異性靶向和消除艱難梭菌的有效性。他們能夠在實驗室中和在小鼠身上進行的實驗中證實這種病原體減少了。
8.Nat Cell Biol:開發出CRISPR-HOT工具對特定基因和細胞進行熒光標記
doi:10.1038/s41556-020-0472-5
在一項新的研究中,來自荷蘭胡布勒支研究所等研究機構的研究人員開發出一種新的遺傳工具,用于標記人類類器官中的特定基因。他們使用這種稱為CRISPR-HOT的遺傳工具來研究肝細胞如何分裂和具有太多DNA的異常肝細胞如何出現。通過讓癌基因TP53失去功能,他們發現異常肝細胞的非結構化分裂更為頻繁,這可能有助于促進癌癥產生。相關研究結果近期發表在Nature Cell Biology期刊上,論文標題為“Fast and efficient generation of knock-in human organoids using homology-independent CRISPR–Cas9 precision genome editing”。
幾年前,科學家們已發現,就像微小分子剪刀一樣發揮作用的CRISPR/Cas9可以精確地切割DNA中的特定位置。這種新技術極大地幫助和簡化了基因工程。論文共同第一作者、胡布勒支研究所的Delilah Hendriks說,“DNA中的較小切口可以激活細胞中的兩種不同的修復機制,這兩種機制可被人們用來迫使細胞在切口部位攝取新的DNA片段。”其中的一種修復機制稱為非同源末端連接(non-homologous end joining),被認為經常犯錯,因此直到現在仍不常用來插入新的DNA片段。論文共同第一作者、胡布勒支研究所的Benedetta Artegiani說,“鑒于早期的一些小鼠研究已表明可以通過非同源末端連接插入新的DNA片段,因此我們著手在人類類器官中測試這一點。”Artegiani和Hendriks隨后發現通過非同源末端連接將任何DNA片段插入人類類器官,實際上比迄今為止使用的另一種稱為同源介導修復(HDR)的修復機制更有效,更穩健。他們將這種新方法命名為CRISPR-HOT。
這些研究人員隨后使用CRISPR-HOT將熒光標記插入人類類器官的DNA中,從而使得這些熒光標記附著在他們想要研究的特定基因上。首先,他們標記了腸道中非常罕見的特定類型的細胞:腸內分泌細胞(enteroendocrine cell)。這些細胞產生激素來調節血糖水平、食物攝取和胃排空等功能。鑒于這些細胞非常稀有,因此很難研究它們。然而,通過使用CRISPR-HOT,他們可以輕松地將這些細胞“涂成”不同的顏色,然后輕松地對其進行識別和分析。其次,他們給源自肝臟中特定細胞類型---膽管細胞---的類器官涂上不同的顏色。他們使用CRISPR-HOT可視化觀察了角蛋白(keratin),即參與細胞骨架的蛋白。鑒于他們可以以高分辨率查看這些角蛋白的詳細信息,他們以超結構化的方式發現了它們的組裝。當細胞發生特化或分化時,這些角蛋白也會改變表達。因此,他們預計,CRISPR-HOT可能能夠用于研究細胞命運和分化。
9.Nat Chem Biol:科學家開發出新型Cas9突變體 有望未來讓基因編輯變得更加精準
doi:10.1038/s41589-020-0490-4
“基因魔剪”CRISPR-Cas9引起能在特殊靶向位點切割DNA而徹底改變了遺傳學領域的研究,如今研究人員能利用Cas9酶來專門關閉基因的表達,或將新型DNA片段插入到基因組中,但不論Cas9有多么專一特殊,其都會切開一些不該切開的位點;近日,一項刊登在國際雜志Nature Chemical Biology上的研究報告中,來自德國馬丁路德大學的科學家們通過研究報道了一種新型的Cas9突變體,其或能增加基因編輯的特異性。
如今科學家們嘗試利用不同的方法來優化Cas9的特異性,當前研究中,研究人員就對Cas9中名為螺旋橋(bridge helix)的進化保守結構域進行了深入研究。研究者發現,這種螺旋橋在Cas9與其導向RNA和DNA靶點相互作用上的機制上扮演著關鍵角色,隨后他們識別出了一組氨基酸殘基,其能與導向RNA的磷酸骨架接觸,從而促進穩定回路結構的形成,后者對于Cas9的活性非常重要,在這種回路結構中,Cas9結合導向RNA就能與DNA靶向序列的互補鏈進行配對,同時還會替換第二股DNA鏈,從而使得Cas9就能切割兩條DNA鏈。
研究者通過改變這些氨基酸殘基就能產生新的Cas9突變體,他們發現,相比原始的Cas9酶而言,多個突變體切割脫靶位點的頻率明顯變低了,后期深入研究后研究者發現,其中一種名為R63A/Q768A的突變體還能夠增加人類細胞中Cas9基因編輯的特異性;本文研究結果或為后期科學家們有效優化CRISPR-Cas9奠定了基礎,目前研究人員還需要后期進行更為深入的研究來解析CRISPR-Cas系統的生化特性從而有效改善其編輯準確性。
10.Nat Biotechnol:將CRISPR/Cas9與納米孔測序相結合實現靶向測序
doi:10.1038/s41587-020-0407-5
為了尋找對人類基因組進行測序并讀取DNA關鍵變化的新方法,來自美國約翰霍普金斯大學醫學院的研究人員在一項新的研究中成功地使用了基因切割工具CRISPR/Cas9在較長的腫瘤基因周圍進行了DNA切割,以用于收集序列信息。他們在來自人類乳腺癌細胞和組織的基因組中進行概念驗證實驗。相關研究結果近期發表在Nature Biotechnology期刊上,論文標題為“Targeted nanopore sequencing with Cas9-guided adapter ligation”。
在實驗中,Timp和博士生Timothy Gilpatrick能夠利用CRISPR對從乳腺癌患者的一小部分腫瘤組織中分離出來的DNA進行靶向切割,從而能夠跳過常規測序的DNA復制部分。隨后,他們將所謂的“測序接頭(sequencing adaptor)”附著到DNA片段的CRISPR切割末端上。這些測序接頭充當把手的作用,將DNA引導到讀取其堿基序列的“納米孔(nanopore)”中。通過讓DNA穿過這個狹窄的納米孔,測序儀可以根據每個化學代碼(即堿基)滑過該孔時產生的獨特電流來產生DNA堿基的讀數。
這些研究人員表示,將CRISPR與對人類癌癥組織的DNA成分進行測序的工具相結合有朝一日可能能夠實現對患者腫瘤的快速、相對便宜的測序,從而簡化針對高度特異性的個人基因改變的治療方法的選擇和使用。
11.bioRxiv:科學家基于CRISPR-Cas12技術開發出了一種超靈敏、快速便攜式的新型冠狀病毒檢測技術
doi:10.1101/2020.02.29.971127
近日,一篇發表在預印版平臺bioRxiv上題為“An ultrasensitive, rapid, and portable coronavirus SARS-CoV-2 sequence detection method based on CRISPR-Cas12”的研究報告中,來自布宜諾斯艾利斯大學等機構的科學家們通過研究基于CRISPR-Cas12技術開發了一種超靈敏、快速、便攜式的新型冠狀病毒(SARS-CoV-2)檢測技術。
CRISPR是一種以在基因編輯領域的應用而出名的生物技術,值得注意的是,近來研究人員已經開始使用CRISPR來進行核酸的體外檢測,因此其就有望被開發成為一種強大精確的分子診斷工具;在CRISPR-Cas效應子家族中,Cas12是一種RNA導向的DNase,其屬于II類V-A系統,該系統能在識別靶點后誘導任意單鏈DNA(ssDNA)的分裂,這就會導致ssDNA報道子的降解,并在分裂位點釋放熒光信號,這就能通過一種便攜式的方法進行檢測。
這項研究中,研究人員報告了一種基于CRISPR-Cas12的新型診斷工具,其能在原理論證的評估中對合成性的SARS-CoV-2的RNA序列進行檢測,研究結果表明,該工具是一種超靈敏、快速且極具潛力的檢測手段,對于有效實現目前資源相對缺乏的地區進行SARS-CoV-2的檢測至關重要。后期研究人員還會繼續深入研究來進一步優化該設備使其更加高效地對SARS-CoV-2進行檢測。
12.Nature怒贊:里程碑!首次用CRISPR在人體內治療疾病!
doi:10.1038/d41586-020-00655-8
一名遺傳導致失明的患者成為了第一個直接接受CRISPR-Cas9基因治療的患者。這項治療是一項具有里程碑意義的臨床試驗的一部分,目的是測試CRISPR-Cas9基因編輯技術去除突變的能力,這種突變會導致一種罕見的情況,即萊伯氏先天性黑蒙癥(LCA10)。這種疾病是導致兒童失明的主要原因,目前尚無治療方法。
在最新的試驗中,基因編輯系統的組成部分--編碼在一種病毒的基因組中--被直接注射到眼睛里,接近光感受器細胞。相比之下,以前的CRISPR-Cas9臨床試驗已經使用這種技術來編輯從體內移除的細胞的基因組,然后再把這些細胞輸回病人體內。
"這是一個激動人心的時刻,"波特蘭俄勒岡健康與科學大學(Oregon Health & Science University)的遺傳視網膜疾病專家Mark Pennesi說。Pennesi正與馬薩諸塞州劍橋的Editas Medicine制藥公司和都柏林的Allergan制藥公司合作,進行這項被稱為"BRILLIANCE"的試驗。
13.Nature熱評:CRISPR正推動CAR-T細胞快速前進
doi:10.1038/d42473-019-00443-7
在過去的十年里,一種新的免疫治療工具進入了臨床。被設計成表達嵌合抗原受體的T細胞,即CAR-T細胞,已經被證明可以幫助血癌患者。2011年的一項關鍵研究使用第二代CAR-T細胞來實現大多數測試患者T細胞的持續激活和緩解。一年后出現了另一個重大突破,兩個小組描述了一種名為CRISPR-Cas9的新型基因編輯工具,并演示了它在真核細胞中的應用。這兩份報告幫助開啟了基因編輯的新時代。盡管基因編輯有可能改善細胞工程,但CAR-T細胞和CRISPR的交叉還需要幾年時間。
從一開始,CRISPR就像是制造T細胞的理想方法。這是一個簡單的過程,具有最小的脫靶效應,適用于多種細胞類型。但CRISPR在一個領域遇到了困難。CRISPR-Cas9通過產生靶向雙鏈DNA (dsDNA)斷裂,然后通過細胞的非同源末端連接途徑修復,從而有效地產生小的突變。然而,當使用同源導向的修復機制插入外源DNA時,CRISPR編輯的效率可能低得可憐。然而,插入DNA對于制造CAR-T細胞至關重要。
去年,Alexander Marson、Gurumurthy和他的同事們利用Easi-CRISPR對人類T細胞的結構和功能進行了重新編程,且不需要病毒載體。本研究表明,將ssDNA作為同源性導向的修復模板對T細胞進行CRISPR編輯,與dsDNA模板相比,能夠更準確、更有效地進行大規模的基因插入,并且脫靶整合概率更低。
雖然有希望,但還有一個重要的考慮:長ssDNA序列很難在實驗室中產生,尤其是在基因編輯實驗中需要高濃度的長ssDNA。一些公司和研究開發人員正試圖解決這個問題,他們正在研究有效生成大量長ssDNA的方法。總部位于新澤西州皮斯卡塔韋(Piscataway)的全球生物技術公司GenScript以其領先的DNA合成技術而聞名。該公司最近開始提供數千個核苷酸長度的ssDNA,數量可達100微克--這是使用CRISPR進行T細胞重編程的理想選擇。GenScript也是為數不多的提供完整的CRISPR解決方案的公司之一,包括HPLC純化的、化學合成的sgRNAs,并通過末端修飾來增強CRISPR編輯。
基因編輯正在改變研究人員研究細胞工程的方式。像Easi-CRISPR這樣的方法,連同DNA和RNA合成的改進,將進一步加強CAR-T細胞工程的努力,最終改善癌癥治療和人類健康。