病例資料:
患者,男性,73歲,因“反復腹痛1年,加重伴解黑便7天”于外院行腹部CT提示“胃癌可能”,為明確診斷而入院。
入院后查血常規提示血紅蛋白69g/L,大便常規提示隱血(±),腫瘤標志物、血液生化等檢查結果均無明顯異常。
腹部增強CT 提示:胃竇部胃壁增厚,胃癌可能,肝內低密度灶,右腎囊腫,右腎小結石。胃鏡檢查提示:胃竇大彎側息肉樣隆起,高位胃體后壁黏膜粗糙,性質待定,胃炎">萎縮性胃炎">慢性萎縮性胃炎(見圖1);胃鏡活檢病理提示:(胃竇小彎側)黏膜慢性輕度萎縮性炎伴中度腸化,Hp(-)。超聲內鏡檢查提示:胃壁彌漫性增厚伴黏膜下層囊性病變,深在性囊性胃炎首先考慮;并對胃體病變行內鏡下黏膜切除術(EMR)(見圖2)。術后病理提示:胃體大彎側黏膜慢性炎伴黏膜下層囊性擴張腺體(見圖3)。
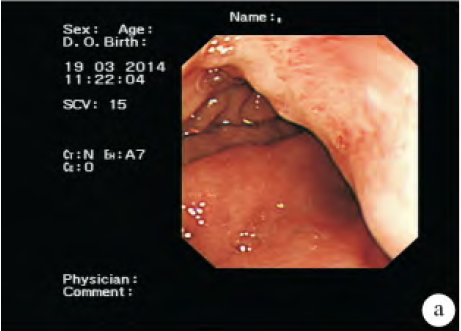
注:圖1 胃鏡下表現
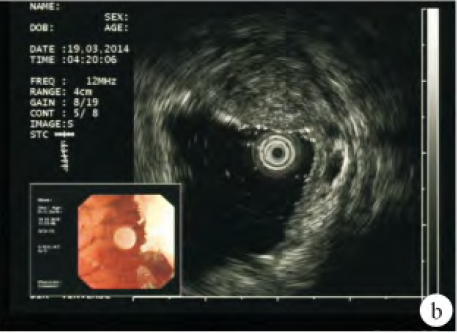
注:圖2 超聲胃鏡下表現
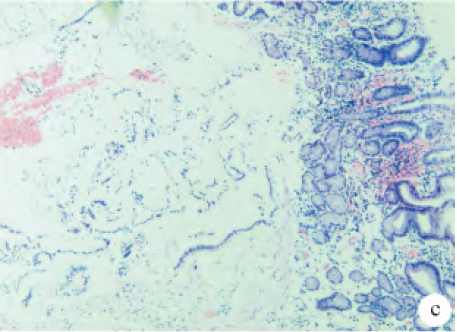
注:圖3 EMR術后病理(HE×100)
討論:
GCP最早于1972年被報道,當時Littler等報道了1例胃腸吻合口處胃黏膜脫垂伴囊狀浸潤性增生的病例,并將其命名為囊狀息肉狀胃炎。隨后關于此病有不同的報道,并分別被命名為囊狀胃炎、胃囊狀息肉病、胃腺囊狀擴張、吻合口息肉樣增生性胃炎、液性囊性胃炎、多發性息肉樣囊性胃炎等。直到1981年Franzin等對81例胃標本進行詳細研究,發現這種腺體改變酷似發生于結腸的深在性囊性結腸炎的病變特點,建議將該病命名為深在性囊性胃炎,此命名才被廣泛接受。
最初GCP多在胃腸吻合口處發現,外科手術對胃黏膜的創傷便成了首先考慮的因素。通常認為,由于慢性炎性反應、缺血、手術、異物(縫線)等因素可使黏膜肌層斷裂,胃腺上皮從固有膜穿過黏膜肌層向黏膜下層移行并生長擴張成囊所致,與Hp感染不一定相關。近年來隨著EMR的開展,在既往無胃部手術史的患者中亦有檢出,故有觀點認為這種胃炎可能是一種先天性疾病,或是一種變性而不是炎性反應,亦可能是萎縮性胃炎的一種變異。GCP的臨床表現不典型,可表現為腹部或胸骨后疼痛、腹瀉、惡心嘔吐、腹部不適、食欲下降、消瘦等,也可因病灶出血而有黑便、貧血等。體檢通常無特異性。
輔助檢查方面,上消化道鋇餐造影可發現有較大充盈缺損,也可見有黏膜脫垂。螺旋CT檢查可見胃壁不規則增厚隆起或伴有腔內腫塊的表現。胃鏡下可見單發或多發無蒂息肉樣病變,表面黏膜呈紅色、光滑,中心可有凹陷。超聲內鏡檢查可發現較為特異性的表現,如大范圍的胃壁增厚和黏膜下層低回聲區。組織病理學檢查可見,除淋巴細胞浸潤、活動性炎性反應、單核細胞及含有Rusell小體的漿細胞等一般炎性反應改變外,還可見腺體間質結締組織增生,病灶處胃的上皮細胞增生活躍,可見胃小凹的延長,增生活躍的上皮細胞常使胃小凹的內表面呈鋸齒狀。胃腺體呈囊狀擴張,不同程度擴張的胃體腺、幽門腺或化生性腺體向黏膜深層及黏膜下浸潤,腺體組織形態多無異常,腺體不分泌硫酸黏液,擴張的腺體較規則、完整,與胃癌存在區別。實驗室檢查通常無特異性。本病臨床表現不典型,胃鏡下普通活檢和套扎活檢取材較表淺難以取到病變部位,故GCP術前確診困難,國內報道的22例中僅1例通過EMR確診,其余均通過胃大部切除術后病理確診。EMR術或內鏡黏膜下剝離術(ESD)因能大塊切除病變獲得整體標本,可提高診斷率。GCP的確診需病理檢查結果。本例患者的臨床表現無特異性,行胃鏡常規檢查時發現胃體病變,后進一步行超聲胃鏡檢查,經EMR術后病理確診。GCP主要需與胃癌相鑒別,前者胃鏡下病變隆起處黏膜色澤與周圍正常胃黏膜色澤相近,表明光滑,無糜爛、潰瘍或附著污苔等,周圍黏膜組織無僵硬感,吻合口無狹窄,最終診斷依靠病理結果。GCP還需與肥厚性胃炎、胃淋巴瘤、間質瘤、Brunner腺增生等疾病相鑒別。
胃大部切除術或全胃切除術是根治胃部疾病的最佳途徑,但術后的膽汁反流、縫線異物和胃黏膜損傷均能影響GCP的發生發展。隨著內鏡操作技術的不斷成熟,ESD及EMR已逐步成為GCP的首選治療方法。盡管GCP的生物學行為看似良性,但也有學者認為該病可同時并發胃癌,其Ki-67、p53和p21WAF1/CIP1的高表達,基因KCNE2的低表達可能與癌變相關,故確診后需行內鏡下治療或密切隨訪。